清华大学免疫所董晨课题组发现Tr17调节性细胞亚群
清华大学免疫所董晨课题组发现Tr17调节性细胞亚群
2017年10月3日,清华大学免疫所董晨课题组在《Cell Reports》上在线发表了题为《Generation of RORγt+antigen-specific T regulatory 17 cells from Foxp3+ precursors inautoimmunity》的研究论文。该论文发现了在免疫反应和自身免疫疾病中,淋巴结中能产生一种表达RORγt的抗原特异的Treg细胞。与此前在肠道中发现的RORγt阳性的Treg细胞不同,它们来源于胸腺tTreg细胞,有着独特的转录谱,因此被命名为Tr17细胞。Tr17细胞通过IL-6-STAT3信号通路诱导而成,能够通过抑制自体反应的效应T细胞从而调控自身免疫疾病。
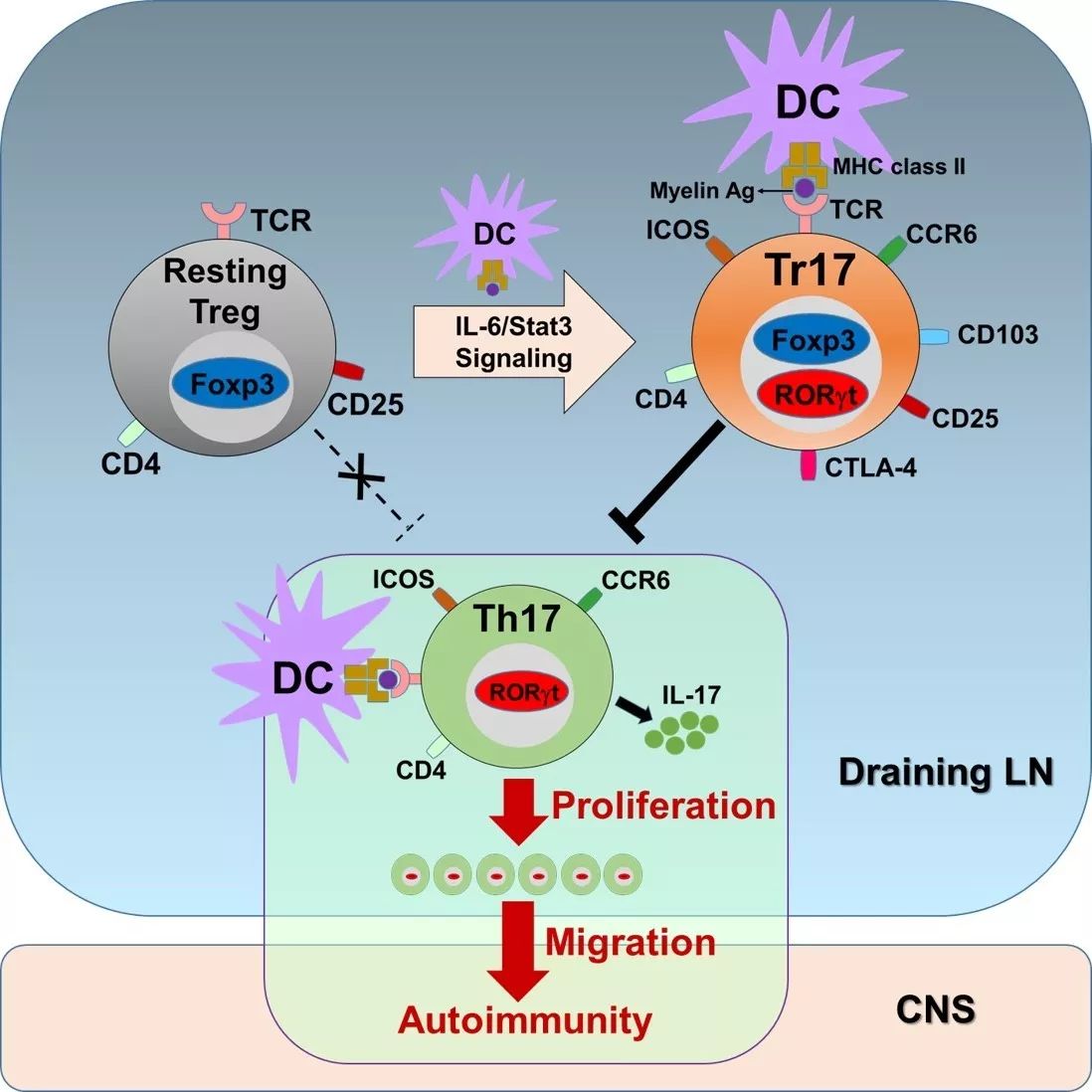
Th17细胞被董晨等课题组发现跟多种自身性免疫疾病密切相关,RORγt是其发育的关键转录因子,RORγt缺失的T细胞几乎不能发育成Th17细胞,并且RORγt缺失小鼠的自身免疫性疾病如EAE等会大大减轻。调节性T细胞(Treg细胞)对于调节免疫反应,抑制自身性免疫疾病的发生至关重要,近年来发现Treg细胞能分成不同的亚型,分别调控不同的辅助性T细胞。尽管此前RORγt阳性的Treg细胞已被发现,但其发育过程、前体来源以及是否稳定存在一直存有争议,并且近期两篇研究中发现的肠道特有的RORγt+ Treg细胞是否广泛存在于外周以调节外周免疫反应并不清楚。
董晨课题组通过用MOG抗原免疫小鼠后发现,外周的引流淋巴结中有很高比例的Treg细胞呈现RORγt阳性,与未免疫的小鼠相比显著增加。进一步的研究发现该细胞有着特殊的的表面标记,高表达Th17细胞特异的趋化因子受体CCR6,并且结合高表达的ICOS蛋白可以在Treg细胞中鉴定出Tr17细胞。值得注意的是,同时在受体鼠中转入外源的tTreg和初始T细胞并免疫后发现,该细胞来源于胸腺发育的tTreg细胞,并且呈现Helios阳性—tTreg细胞的特有标记,说明Tr17细胞与此前发现的由初始T细胞在肠道中分化形成的RORγt+ Treg并不是同一种细胞。而通过用不同的抗原免疫含有抗原特异T细胞的小鼠后发现,该细胞的发育是由胸腺tTreg细胞在外周经过抗原刺激形成,具有抗原特异性。此外,Tr17细胞的转录谱与常规的Treg细胞以及肠道RORγt+ Treg细胞都有较大的不同,并且高表达Th17相关基因如IL-17。接下来的体内外实验发现,Tr17细胞中RORγt的表达受到IL-6-STAT3信号通路的调控,而RORγt对于Tr17细胞的特性如CCR6分子的表达至关重要。进一步的功能实验发现,Tr17在体外能够有效抑制抗原特异的效应T细胞,在体内能够抑制Th17介导的自身性免疫疾病EAE,说明尽管该细胞高表达RORγt和IL-17,但仍是具有免疫抑制功能的活化的Treg细胞。
关于RORγt+ Treg的细胞特性一直存有争议。董晨课题组这一工作发现了该细胞在免疫反应中的普遍、稳定存在,并且与肠道RORγt+ Treg细胞不同,它们来源于胸腺的tTreg细胞,在免疫反应中受到抗原刺激后产生,同时又具有抑制功能,能在小鼠中抑制Th17介导的自身免疫性疫病EAE,因此被命名为Tr17细胞。该工作清晰地阐明了Tr17细胞的来源、发育及功能,并且鉴定出它的表面标记分子。Tr17 和Th17同时在炎症反应中产生,有相似的基因表达,但是具有不同的生物学功能,阴阳拮抗,这一发现为Th17介导的自身免疫性疾病提供了新治疗思路。
董晨课题组的前博士后Byung-Seok Kim为该文的第一作者,MD Anderson癌症中心的Seon Hee Chang为该文的共同通讯作者,论文的其他作者还包括来自清华大学、中科院和美国辛辛那提大学、新墨西哥大学等多个单位的研究者。
原文链接:http://www.cell.com/cell-reports/fulltext/S2211-1247(17)31296-2